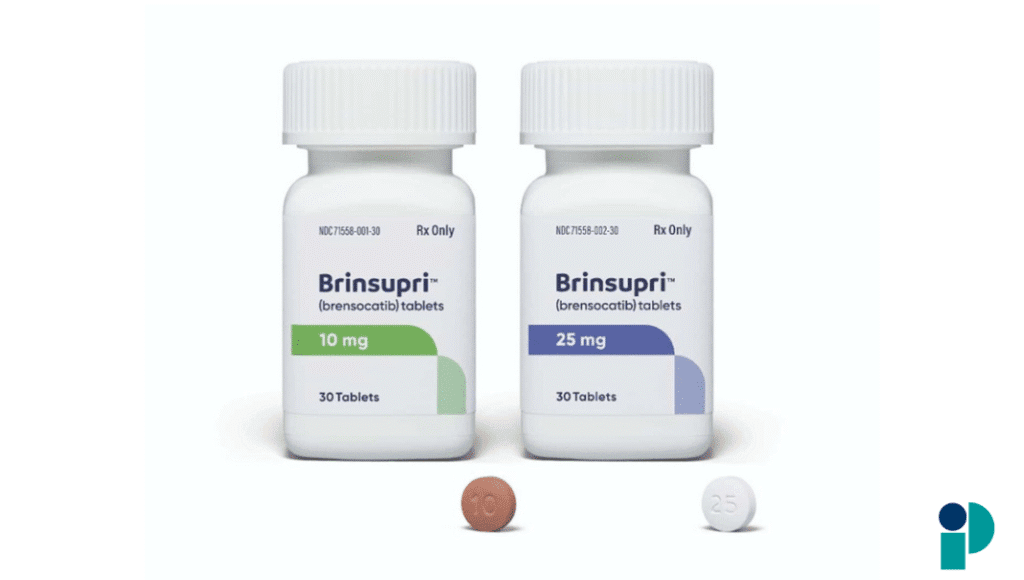
La Administración de Alimentos y Medicamentos de Estados Unidos (FDA) aprobó BRINSUPRI™ (brensocatib), el primer y único medicamento indicado para tratar la bronquiectasia no asociada a fibrosis quística (NCFB) en adultos y adolescentes desde los 12 años. Esta aprobación ofrece por primera vez una opción terapéutica específica para una condición que afecta a cerca de 500,000 personas en EE. UU. y millones en el mundo.
¿Qué es la bronquiectasia no asociada a fibrosis quística?
La NCFB es una enfermedad pulmonar crónica en la que los bronquios se dilatan permanentemente debido a un ciclo de infección, inflamación y daño del tejido pulmonar. Esto dificulta la expulsión de mucosidad y bacterias, favoreciendo infecciones recurrentes y un deterioro progresivo de la función pulmonar. Los síntomas más comunes incluyen tos crónica, aumento en la producción de moco, falta de aire y fatiga. Los episodios de empeoramiento, llamados exacerbaciones, son frecuentes y pueden requerir hospitalización.
BRINSUPRI es un inhibidor de la dipeptidil peptidasa 1 (DPP1) que bloquea la activación de enzimas inflamatorias (proteasas serinas de neutrófilos) responsables del daño crónico en las vías respiratorias. Se administra por vía oral, una vez al día, en dosis de 10 mg o 25 mg.
En el estudio clínico fase 3 ASPEN, los pacientes tratados con BRINSUPRI redujeron en un 21.1% (10 mg) y 19.4% (25 mg) el promedio anual de exacerbaciones frente al placebo. Además, el medicamento prolongó el tiempo hasta la primera exacerbación y ayudó a preservar la función pulmonar.
Reacciones adversas y precauciones
Los efectos secundarios más comunes reportados en el ensayo ASPEN incluyeron:
- Infecciones de vías respiratorias superiores
- Dolor de cabeza
- Erupción cutánea
- Sequedad de la piel
- Hipertensión
- Cambios en las encías y encías inflamadas (en algunos casos)
La compañía recomienda revisiones dermatológicas y dentales periódicas durante el tratamiento, y evitar vacunas vivas atenuadas mientras se esté usando BRINSUPRI.
Impacto y próximos pasos
Para especialistas como la Dra. Doreen Addrizzo-Harris, profesora de medicina pulmonar en NYU Grossman School of Medicine, esta aprobación representa “un cambio de paradigma” al abordar directamente una causa raíz de las exacerbaciones en la NCFB.
Insmed, la farmacéutica desarrolladora, ya ha iniciado procesos regulatorios en Europa y el Reino Unido, y planea presentar solicitud en Japón en 2025. El lanzamiento comercial fuera de EE. UU. se prevé para 2026, sujeto a aprobaciones.
Fuente original aquí