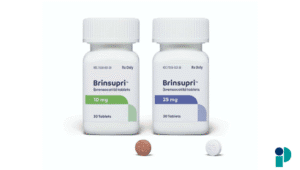
El Reino Unido ha autorizado por primera vez un tratamiento farmacológico específico para los tumores desmoides, una enfermedad rara y de difícil manejo clínico. La Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA, por sus siglas en inglés) aprobó el uso del hidrobromuro de nirogacestat (Ogsiveo), desarrollado por SpringWorks Therapeutics, para el tratamiento de adultos con tumores desmoides progresivos.
La decisión marca un hito en el abordaje de esta patología en el país y se produce tras la aprobación del fármaco por parte de la Comisión Europea en agosto de 2025. Hasta ahora, no existían en el Reino Unido terapias farmacológicas autorizadas específicamente para esta enfermedad.
Los tumores desmoides se originan en el tejido conectivo y afectan con mayor frecuencia a las extremidades y al abdomen. Aunque no producen metástasis, pueden crecer de forma agresiva e infiltrar estructuras cercanas, provocando dolor, limitación funcional y complicaciones significativas.
La resección quirúrgica completa suele ser compleja y conlleva un riesgo elevado de morbilidad, lo que ha impulsado la búsqueda de alternativas terapéuticas menos invasivas.
El nirogacestat es un inhibidor de la gamma secretasa que actúa sobre la vía de señalización Notch, un mecanismo clave en el crecimiento de estos tumores. Se trata del primer fármaco dirigido específicamente a esta diana molecular para el tratamiento de los tumores desmoides.
“La seguridad del paciente es nuestra máxima prioridad”, afirmó Julian Beach, director ejecutivo interino de calidad y acceso a la atención médica de la MHRA. Según el funcionario, esta aprobación permitirá mejorar la salud y la calidad de vida de los adultos que viven con esta enfermedad poco frecuente.
Evidencia clínica y beneficios para los pacientes
La autorización se basó en los resultados del ensayo clínico DeFi de fase 3, en el que participaron 142 pacientes que recibieron nirogacestat por vía oral (150 mg dos veces al día) o placebo. El estudio mostró que el fármaco redujo el riesgo de progresión de la enfermedad o muerte en un 71 % en comparación con placebo.
A los dos años, la supervivencia libre de eventos fue del 76 % en el grupo tratado con nirogacestat, frente al 44 % en el grupo placebo. Además, se observó una respuesta objetiva en el 41 % de los pacientes tratados, en comparación con el 8 % de quienes recibieron placebo. Las respuestas completas se registraron en el 7 % de los pacientes del grupo activo y no se observaron en el grupo control.
Los datos también indicaron que los pacientes tratados con nirogacestat requirieron menos intervenciones quirúrgicas y reportaron reducciones sostenidas del dolor, así como mejoras en la función física, aspectos clave en una enfermedad que puede afectar de manera importante la calidad de vida.
Seguridad y precauciones
En cuanto al perfil de seguridad, los efectos adversos más frecuentes incluyeron diarrea, erupción cutánea, náuseas, fatiga, dolor de cabeza, estomatitis e hipofosfatemia. Uno de los riesgos de seguridad más relevantes es la menopausia precoz, que podría afectar a más de una de cada diez pacientes.
El medicamento también puede causar daño fetal y afectar la fertilidad tanto en hombres como en mujeres, por lo que se exige el uso de métodos anticonceptivos altamente eficaces durante el tratamiento. Como parte de las medidas de seguridad, se emitirán tarjetas para pacientes y parejas de pacientes con el fin de reforzar la prevención del embarazo.
La MHRA indicó que continuará supervisando de cerca la seguridad y eficacia del nirogacestat, conforme a los procedimientos estándar para los medicamentos autorizados.