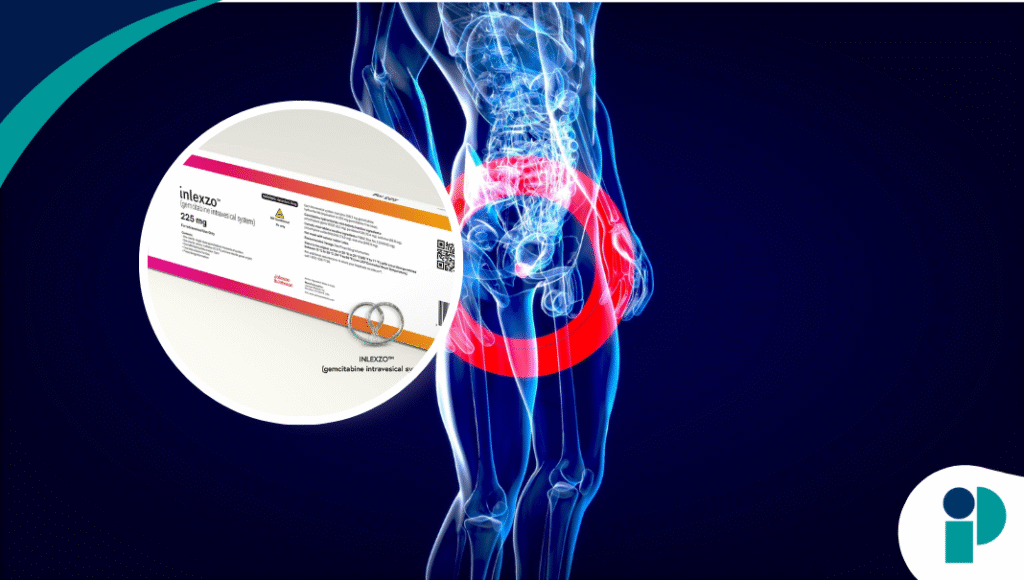
La Administración de Alimentos y Medicamentos de Estados Unidos (FDA) aprobó INLEXZO™ (sistema intravesical de gemcitabina), el primer y único sistema de liberación prolongada de fármacos para el tratamiento de ciertos pacientes con cáncer de vejiga no músculo invasivo (NMIBC) que no responden a la inmunoterapia con bacilo de Calmette-Guérin (BCG).
El nuevo tratamiento, desarrollado por Johnson & Johnson (NYSE: JNJ), ofrece una alternativa a la cistectomía radical —cirugía que implica la extirpación total de la vejiga—, opción que hasta ahora representaba la única salida para muchos pacientes que dejaban de responder al BCG.
De acuerdo con los resultados del ensayo clínico SunRISe-1, el 82 % de los pacientes tratados con INLEXZO alcanzaron una respuesta completa, es decir, la ausencia de signos de cáncer tras el tratamiento. Más de la mitad de ellos mantuvieron dicha respuesta por al menos un año.
“Cuando adquirimos esta novedosa terapia en 2019, nuestra ambición era brindar a los pacientes con cáncer de vejiga una renovada esperanza y confianza”, expresó Jennifer Taubert, vicepresidenta ejecutiva y presidenta mundial de Medicina Innovadora de Johnson & Johnson.
El dispositivo, anteriormente conocido como TAR-200, consiste en un sistema intravesical que libera de manera prolongada gemcitabina directamente en la vejiga durante tres semanas por ciclo, con hasta 14 ciclos posibles. Su colocación se realiza en pocos minutos, de forma ambulatoria y sin necesidad de anestesia general.
Para los especialistas, se trata de un avance que puede redefinir la práctica clínica. “Atiendo a muchos pacientes que finalmente dejan de responder al BCG y a menudo se enfrentan a una extirpación vesical que les cambia la vida. Estos pacientes ahora podrían ser candidatos ideales para INLEXZO”, afirmó la Dra. Sia Daneshmand, investigadora principal del estudio y profesora de Urología en la Universidad del Sur de California.
El potencial de esta nueva terapia también fue destacado por John Reed, MD, Ph.D., vicepresidente ejecutivo de I+D en Johnson & Johnson, quien aseguró: “INLEXZO es una terapia novedosa con una eficacia potente y un perfil de seguridad comprobado. Estamos orgullosos de la ciencia que nos ha llevado a este momento histórico”.
La aprobación de la FDA estuvo respaldada por designaciones especiales como la terapia innovadora (BTD), la revisión oncológica en tiempo real (RTOR) y la revisión prioritaria, lo que refleja la relevancia del tratamiento para una población con necesidades urgentes de nuevas opciones.
Fuente consultada: AQUÍ